La rougeole est une infection virale aiguë extrêmement contagieuse qui touche principalement les enfants, et pour laquelle il n’existe aucun traitement spécifique. Elle se manifeste par une éruption cutanée fébrile associée à des signes d’infection respiratoire.
1.1.1 Importance du problème
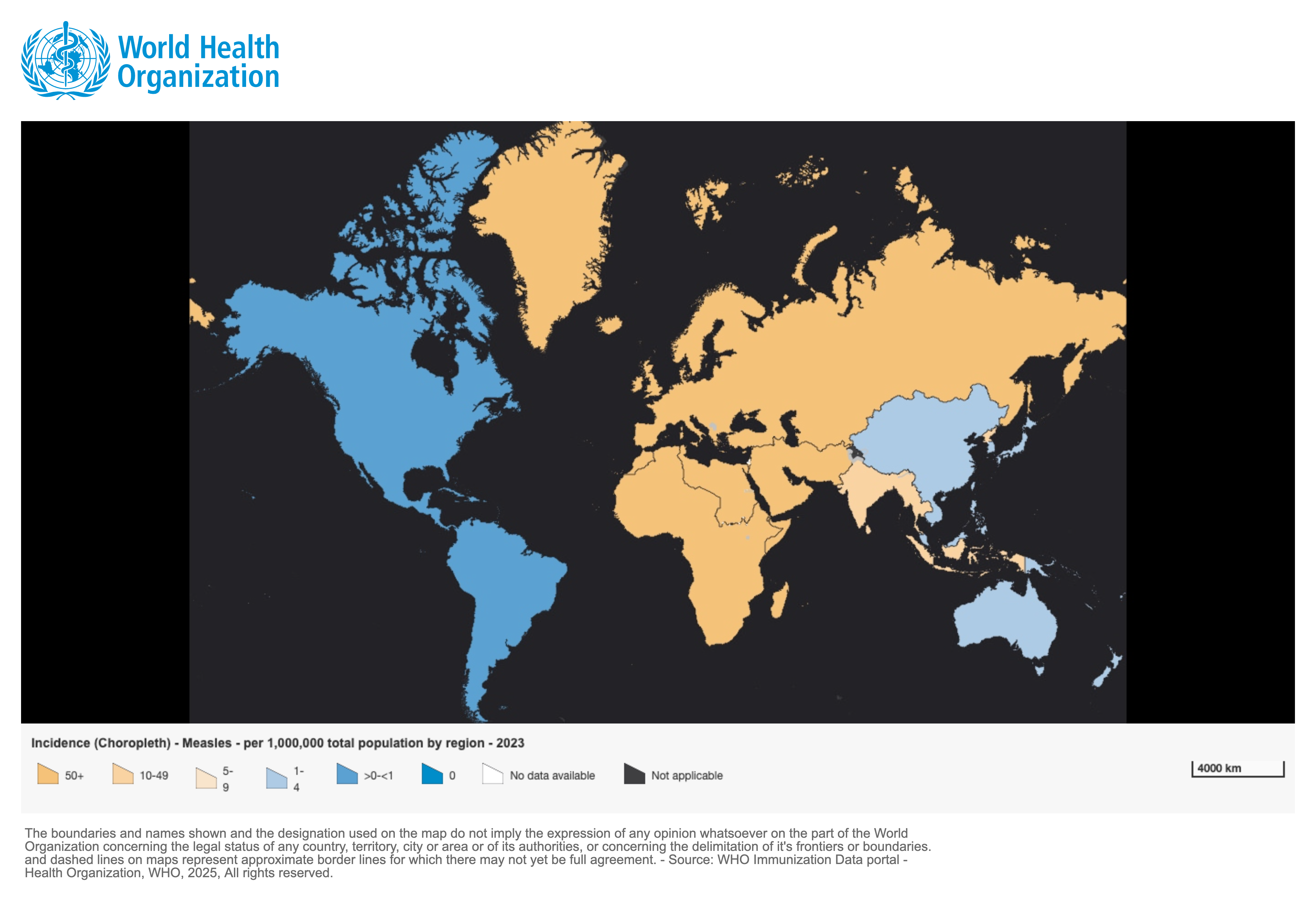
L’introduction d’un vaccin efficace et peu coûteux dans les années 60 a permis de diminuer l’importance de la maladie au niveau mondial. Néanmoins, la rougeole reste un problème majeur de santé publique dans les pays où les faibles couvertures vaccinales atteintes (principalement en Afrique et en Asie aujourd’hui) entraînent la persistance de la transmission de la maladie et sont à l’origine d’épidémies de grande ampleur (Figure 1.1).
En 2023, 167 pays (sur 194) ont déclaré conjointement 669’083 cas de rougeole
[1]Citation 1.Provisional monthly measles and rubella data. World Health Organization. Published March 2024. Available from:
https://www.who.int/teams/immunization-vaccines-and-biologicals/immunization-analysis-and-insights/surveillance/monitoring/provisional-monthly-measles-and-rubella-data
. Selon l’Organisation mondiale de la Santé (OMS), malgré l’amélioration globale de la surveillance épidémiologique, ces chiffres seraient encore largement sous-estimés
[1]Citation 1.Provisional monthly measles and rubella data. World Health Organization. Published March 2024. Available from:
https://www.who.int/teams/immunization-vaccines-and-biologicals/immunization-analysis-and-insights/surveillance/monitoring/provisional-monthly-measles-and-rubella-data
.
Figure 1.1 : Incidence des cas de rougeole déclarés pour 100 000 habitants en 2023
[2]Citation 2.World Health Organization. Measles reported cases and incidence. Accessed March 29, 2025.
https://immunizationdata.who.int/global/wiise-detail-page/measles-reported-cases-and-incidence?CODE=Global&YEAR=
1.1.2 Agent infectieux
La rougeole est due à un paramyxovirus (virus morbilleux), dont le réservoir est exclusivement humain (personnes infectées, y compris asymptomatiques).
24 génotypes répartis en huit clades (désignés par les lettres A à H) sont actuellement connus. Leur répartition est variable selon les régions
[3]Citation 3.Rota PA, Brown K, Mankertz A, et al. Global distribution of measles genotypes and measles molecular epidemiology. J Infect Dis. 2011;204(suppl_1):S514-S523.
https://doi.org/10.1093/infdis/jir118 , [4]Citation 4.Broutin H, Mantilla-Beniers N, Simondon F, Aaby P, Grenfell BT, Guégan JF, Rohani P. Epidemiological impact of vaccination on the dynamics of two childhood diseases in rural Senegal. Microbes Infect. 2005;7(4):593-599.
https://doi.org/10.1016/j.micinf.2004.12.018, [5]Citation 5.Broutin H, Mantilla-Beniers N, Simondon F, Aaby P, Grenfell BT, Guégan JF, Rohani P. Epidemiological impact of vaccination on the dynamics of two childhood diseases in rural Senegal. Microbes Infect. 2005;7(4):593-599. doi: 10.1016/j.micinf.2004.12.018
.
Dans les pays endémiques, la majorité des cas sont dus à un ou plusieurs génotypes endémiques répartis géographiquement, avec de multiples lignées co-circulant au sein du ou des génotypes endémiques.
Dans les régions où la rougeole est très bien contrôlée, la réintroduction d’un cas entraîne généralement des flambées associées à un seul génotype de virus.
La caractérisation moléculaire des virus de la rougeole permet d’en identifier l’origine, de surveiller leur circulation et toute modification du génotype. Elle est indispensable pour documenter l’impact des programmes de lutte contre la rougeole au plan mondial.
1.1.3 Transmission
La transmission se fait principalement par contact direct avec des sécrétions du nez ou de la gorge et par voie aérienne.
Les gouttelettes de Pflügge émises par le sujet infecté contaminent le sujet indemne en pénétrant les muqueuses nasales, buccales, laryngées ou conjonctivales. Le virus peut rester en suspension dans l’air pendant plus de 2 heures, mais survit peu de temps sur les objets et les surfaces.
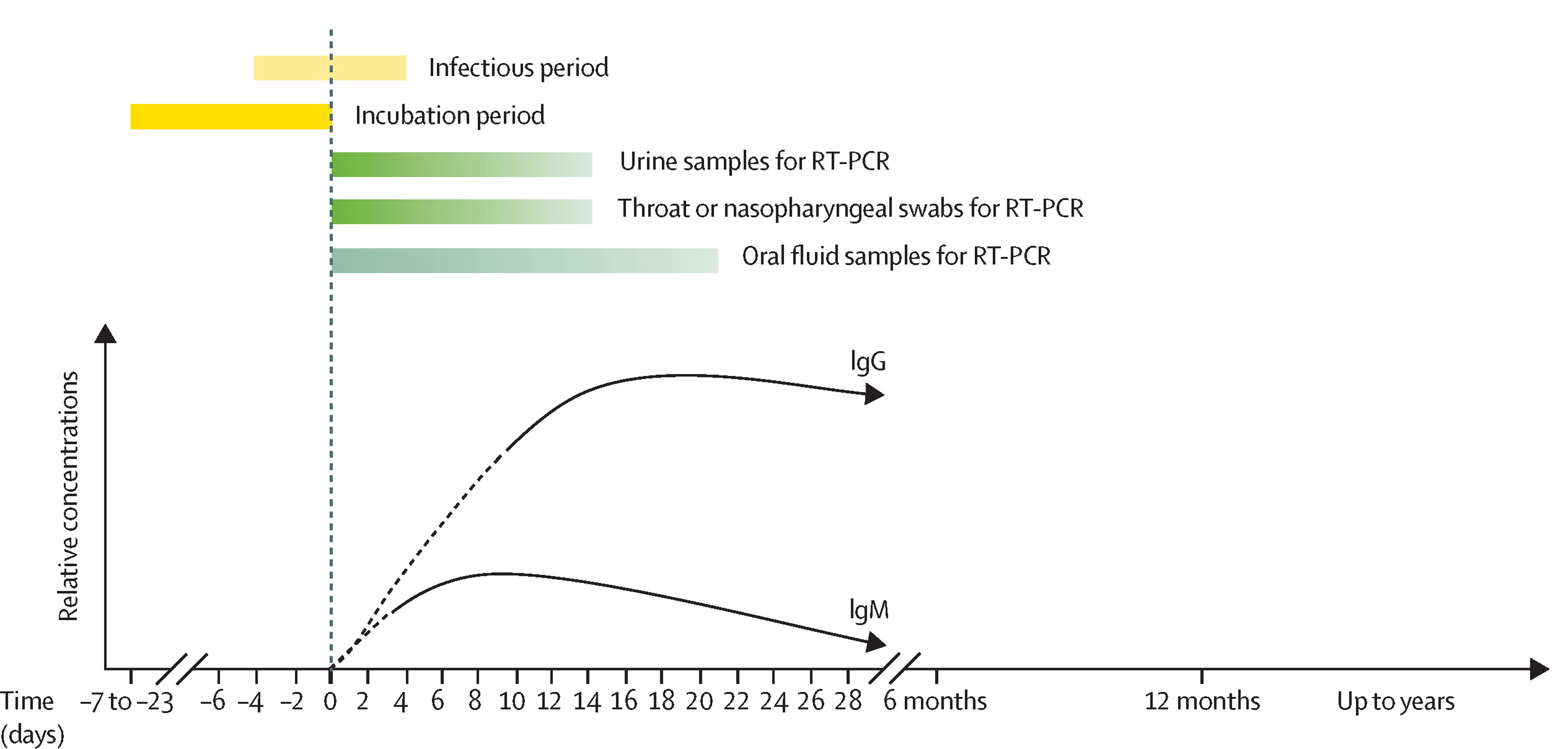
La période de contagiosité débute 3 à 4 jours avant l’apparition de l’éruption cutanée et persiste jusqu’à 5 jours après le début de l’éruption. Elle peut être plus longue chez les sujets malnutris ou immunodéprimés.
La rougeole est très contagieuse. On estime que son taux de reproduction de base R0 est compris entre 12 et 18 (c’est-à-dire qu’un individu atteint de rougeole aigue peut être à l’origine de 12 à 18 cas secondaires dans une population de susceptibles), celui-ci pouvant varier selon le contexte (Voir Section 1.2.3).
1.1.4 Immunité naturelle
L’immunité peut être acquise naturellement (en contractant la maladie) ou par la vaccination.
Chez le sujet contaminé, les anticorps immunoglobulines M (IgM) peuvent être détectés dès l’apparition de l’éruption et persistent pendant environ un mois. Les immunoglobulines G (IgG apparaissent quelques jours plus tard et restent détectables à vie. L’infection naturelle entraîne donc une protection à vie.
Figure 1.2 - Chronologie d'une infection typique par la rougeole et de certaines complications importantes [6]Citation 6.Hübschen JM, Gouandjika-Vasilache I, Dina J. Measles. Lancet. 2022;399(10325):678-690. https://doi.org/10.1016/S0140-6736(21)02004-3
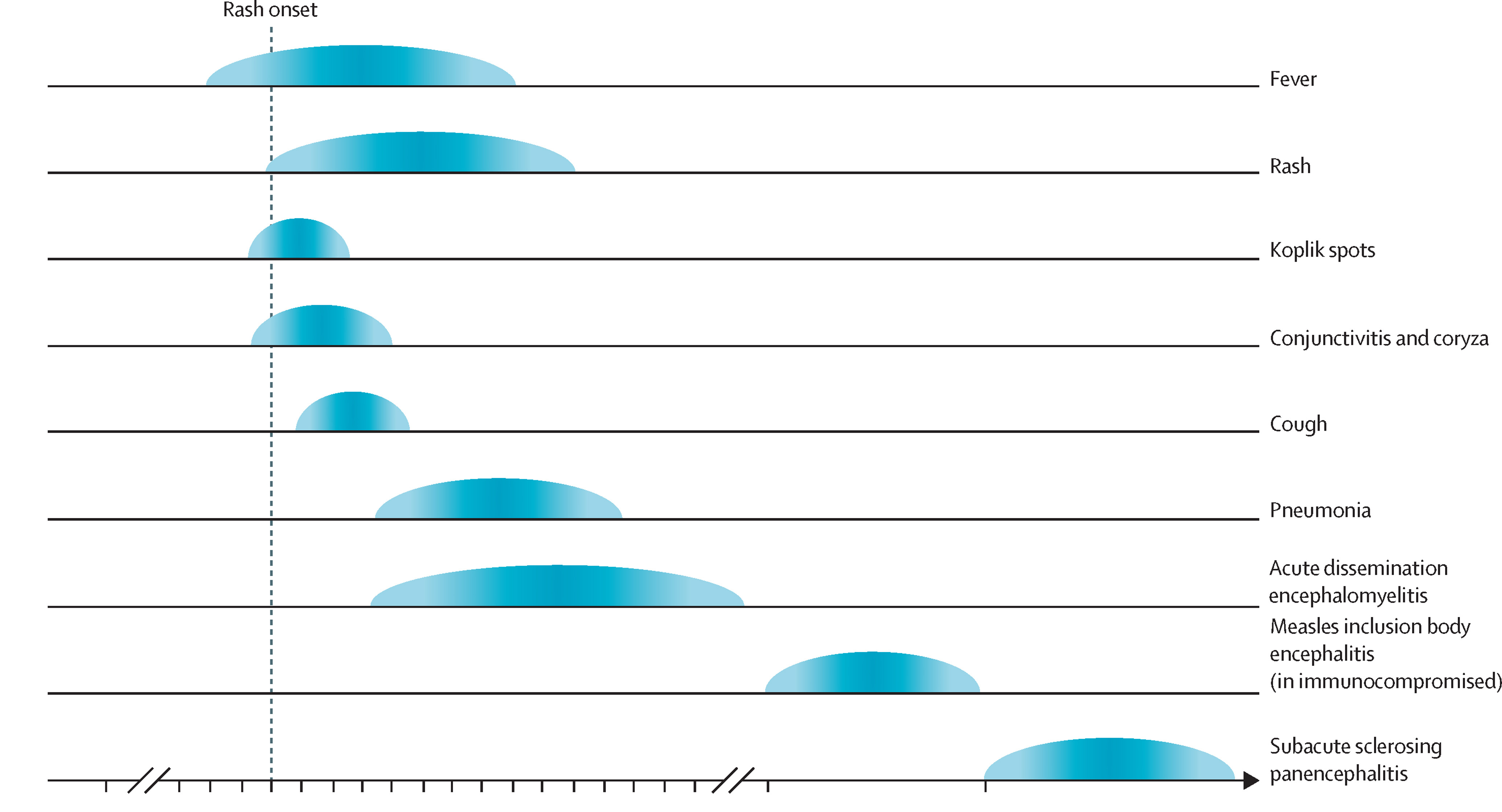
C’est l’activation de la réponse immunitaire qui permet l’élimination du virus lors de la maladie. Cette activation provoque, paradoxalement, la perte de l’immunité préexistante contre des pathogènes rencontrés précédemment
[7]Citation 7.Amurri L, Reynard O, Gerlier D, Horvat B, Iampietro M. Measles virus-induced host immunity and mechanisms of viral evasion. Viruses. 2022;14(12):2641.
doi: 10.3390/v14122641
, connue sous le terme d’amnésie immunitaire
[8]Citation 8.Mina MJ, Kula T, Leng Y, et al. Measles virus infection diminishes preexisting antibodies that offer protection from other pathogens. Science. 2019;366(6465):599-606.
doi: 10.1126/science.aay6485
, laissant le patient réceptif aux infections.
Ce sont principalement les lymphocytes mémoire qui sont altérés et le répertoire d’anticorps est alors significativement réduit puis il va se reconstituer au gré des expositions infectieuses ou de la vaccination. Ce déficit temporaire est majeur les premiers mois puis, au fil du temps, le système immunitaire se rétablit et le patient regagne progressivement sa capacité à se défendre contre d'autres infections pendant les 2 à 5 ans qui suivent
[9]Citation 9.Gadroen K, Dodd CN, Masclee GMC, et al. Impact and longevity of measles-associated immune suppression: a matched cohort study using data from the THIN general practice database in the UK. BMJ Open. 2018;8(11):e021465.
doi: 10.1136/bmjopen-2017-021465
. Refaire les vaccinations pour les autres antigènes semble donc être nécessaire en post rougeole mais les modalités (nombre de doses, calendrier) sont encore à l’étude.
L’amnésie immunitaire explique l’augmentation de la morbidité et de la mortalité post- rougeole constatée depuis longtemps, et largement documentée
[7]Citation 7.Amurri L, Reynard O, Gerlier D, Horvat B, Iampietro M. Measles virus-induced host immunity and mechanisms of viral evasion. Viruses. 2022;14(12):2641.
doi: 10.3390/v14122641, [8]Citation 8.Mina MJ, Kula T, Leng Y, et al. Measles virus infection diminishes preexisting antibodies that offer protection from other pathogens. Science. 2019;366(6465):599-606.
doi: 10.1126/science.aay6485
.
Il est important de noter que le vaccin contre la rougeole n'induit pas ce phénomène.
1.1.5 Vulnérabilité
Les anticorps maternels, transmis via le placenta et le lait maternel, protègent les nourrissons durant les premiers mois de vie puis disparaissent progressivement vers l’âge de 6 à 9 mois.
Après disparition des anticorps, tous les enfants deviennent « susceptibles », c’est-à-dire à risque de développer la maladie en cas de contamination.
C’est la probabilité de contact avec un sujet atteint de rougeole qui déterminera l’âge de survenue de la maladie. La couverture vaccinale, le taux de natalité, la promiscuité et la densité de la population sont donc des facteurs essentiels.
Classiquement, dans les pays où la couverture vaccinale est faible et le taux de natalité élevé, les enfants de moins de 5 ans, et plus spécifiquement de moins de 3 ans, sont les plus touchés, alors que si la couverture vaccinale augmente, l’âge moyen de l’infection rougeole peut se déplacer vers les adolescents ou les jeunes adultes.
Une petite proportion des personnes vaccinées ne développera pas d’immunité à la première dose de vaccin administrée (5 à 15% selon l’âge, voir Chapitre 2, Section 2.1.3). Si la vaccination est réalisée à 9 mois, seuls 85% des enfants sont protégés et 15% sont considérés comme non répondants d’où l’intérêt de la seconde dose de vaccin plus tardive.
En l’absence d’une seconde dose, ces personnes dites non-répondantes seront toujours à risque de développer la maladie en cas de contamination.
1.1.6 Létalité
Dans les pays industrialisés, la létalité est faible et la maladie est souvent, à tort, considérée comme bénigne. L’OMS estime qu’en 2017, 3% des décès d’enfants de moins de 5 ans dans le monde sont attribuables à la rougeole [10]Citation 10.Distribution of causes of death among children aged < 5 years (%). World Health Organization. Available from: https://www.who.int/data/gho/data/indicators/indicator-details/GHO/distribution-of-causes-of-death-among-children-aged-5-years-(-) et que 90% des personnes qui décèdent des suites d’une rougeole ont moins de 5 ans. Si on considère la létalité tardive liée aux complications et/ou à l’amnésie immunitaire post-rougeole, celle-ci est probablement plus élevée mais rarement documentée.
Dans un contexte stable, la létalité de la rougeole en communauté varie de 1 à 5% selon l’état sanitaire du pays, la létalité hospitalière varie entre 1 et 10%
[11]Citation 11.Portnoy A, Jit M, Ferrari M, Hanson M, Brenzel L, Verguet S. Estimates of case-fatality ratios of measles in low-income and middle-income countries: a systematic review and modelling analysis. Lancet Glob Health. 2019;7(4):e472-e481.
https://doi.org/10.1016/s2214-109x(18)30537-0
.
La létalité est très dépendante de :
L’accès aux soins : promptitude, distance à une structure de santé et qualité de la prise en charge des cas simples et compliqués (critères d’hospitalisation et qualité des soins). Les zones rurales à faible accès aux soins sont, par conséquent, à risque de létalité élevée [12]Citation 12.Gignoux E, Polonsky J, Ciglenecki I, et al. Risk factors for measles mortality and the importance of decentralized case management during an unusually large measles epidemic in eastern Democratic Republic of Congo in 2013. In: Arez AP, ed. PLoS One. 2018;13(3):e0194276. doi: 10.1371/journal.pone.0194276 .
La densité de la population : les zones à forte densité démographique comme les zones urbaines pauvres (bidonvilles), les camps de déplacés ou de réfugiés, favorisant une forte exposition au virus, sont également à risque de létalité élevée [13]Citation 13.Aaby P, Bukh J, Lisse IM, Smits AJ. Overcrowding and intensive exposure as determinants of measles mortality. Am J Epidemiol. 1984;120(1):49-63. doi: 10.1093/oxfordjournals.aje.a113874 .
La taille de la famille (plus le nombre d’enfant est élevé, plus le risque est grand) [14]Citation 14.Sbarra AN, Jit M, Mosser JF, et al. Population-level risk factors related to measles case fatality: a conceptual framework based on expert consultation and literature review. Vaccines. 2023;11(8):1389. doi: 10.3390/vaccines11081389 .
Au niveau individuel, les principaux facteurs aggravants sont :
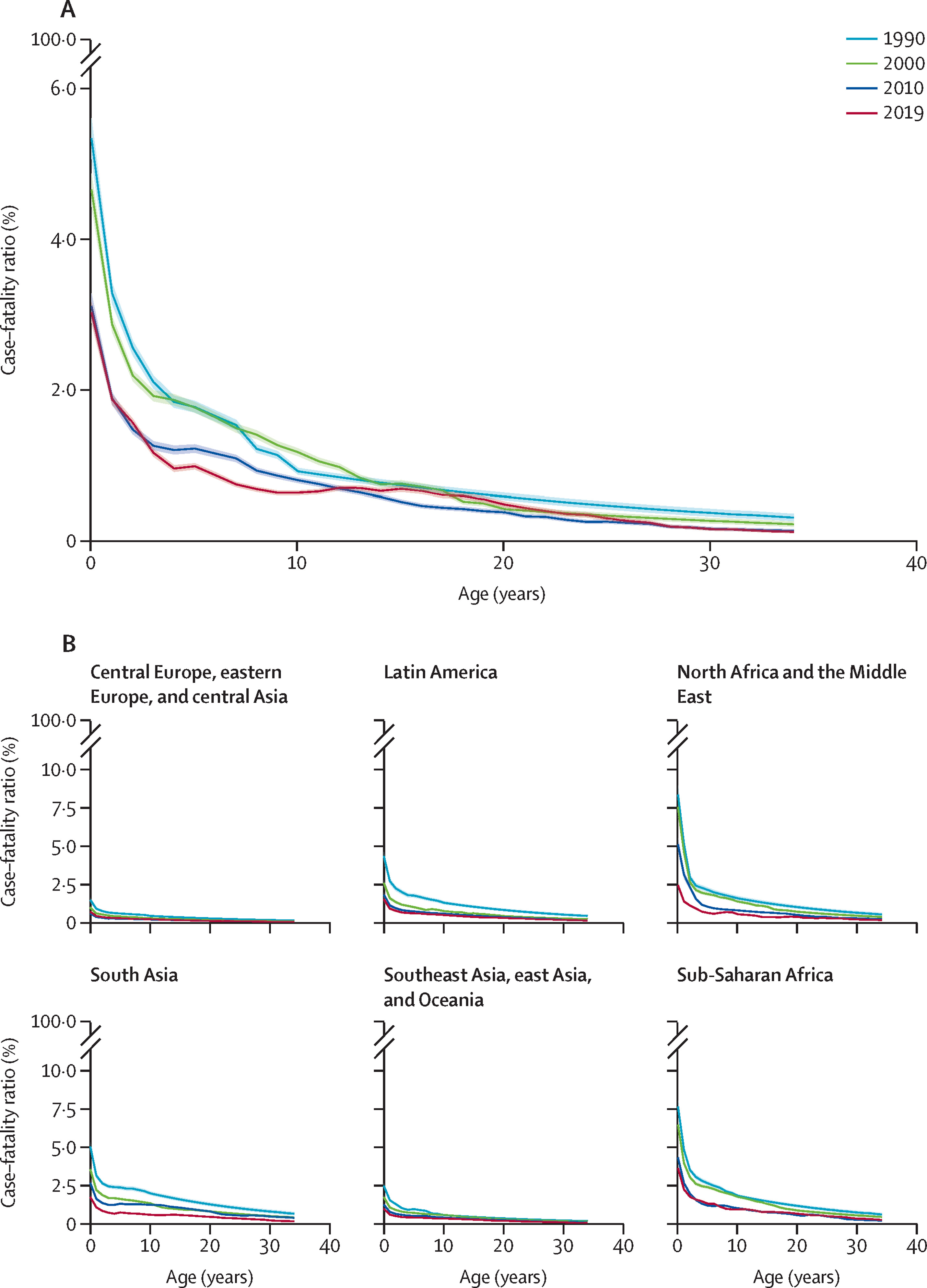
L’âge : la létalité est élevée chez les jeunes enfants, en particulier si la qualité de la prise en charge est limitée, et diminue progressivement avec l’âge (voir Figure 1.3)
La malnutrition aigüe ou chronique
La carence en vitamine A
L’absence de vaccination contre la rougeole
L’immunodépression et en particulier une co-infection par le VIH [15]Citation 15.Sbarra AN, Jit M, Mosser JF, et al. Population-level risk factors related to measles case fatality: a conceptual framework based on expert consultation and literature review. Vaccines. 2023;11(8):1389. Available from: https://doi.org/10.3390/vaccines11081389
Figure 1.3 (A) - Estimation du taux de létalité de la rougeole selon l’âge (en années) en 1990, 2000, 2010 et 2019 et Figure 1.4 (B) - Estimation du taux de létalité de la rougeole par sous-région OMS en 1990, 2000, 2010 et 2019 [16]Citation 16.Sbarra AN, Mosser JF, Jit M, Ferrari M, Ramshaw RE, O’Connor P, et al. Estimating national-level measles case–fatality ratios in low-income and middle-income countries: an updated systematic review and modelling study. The Lancet Global Health [Internet]. 2023 Apr 1;11(4):e516–24. Available from: https://www.sciencedirect.com/science/article/pii/S2214109X23000438
- 1.
Provisional monthly measles and rubella data. World Health Organization. Published March 2024. Available from:
https://www.who.int/teams/immunization-vaccines-and-biologicals/immunization-analysis-and-insights/surveillance/monitoring/provisional-monthly-measles-and-rubella-data
- 2.
World Health Organization. Measles reported cases and incidence. Accessed March 29, 2025.
https://immunizationdata.who.int/global/wiise-detail-page/measles-reported-cases-and-incidence?CODE=Global&YEAR= - 3.
Rota PA, Brown K, Mankertz A, et al. Global distribution of measles genotypes and measles molecular epidemiology. J Infect Dis. 2011;204(suppl_1):S514-S523.
https://doi.org/10.1093/infdis/jir118 - 4.
Broutin H, Mantilla-Beniers N, Simondon F, Aaby P, Grenfell BT, Guégan JF, Rohani P. Epidemiological impact of vaccination on the dynamics of two childhood diseases in rural Senegal. Microbes Infect. 2005;7(4):593-599.
https://doi.org/10.1016/j.micinf.2004.12.018 - 5.
Broutin H, Mantilla-Beniers N, Simondon F, Aaby P, Grenfell BT, Guégan JF, Rohani P. Epidemiological impact of vaccination on the dynamics of two childhood diseases in rural Senegal. Microbes Infect. 2005;7(4):593-599. doi: 10.1016/j.micinf.2004.12.018
- 6.
Hübschen JM, Gouandjika-Vasilache I, Dina J. Measles. Lancet. 2022;399(10325):678-690. https://doi.org/10.1016/S0140-6736(21)02004-3
- 7.
Amurri L, Reynard O, Gerlier D, Horvat B, Iampietro M. Measles virus-induced host immunity and mechanisms of viral evasion. Viruses. 2022;14(12):2641.
doi: 10.3390/v14122641 - 8.
Mina MJ, Kula T, Leng Y, et al. Measles virus infection diminishes preexisting antibodies that offer protection from other pathogens. Science. 2019;366(6465):599-606.
doi: 10.1126/science.aay6485 - 9.
Gadroen K, Dodd CN, Masclee GMC, et al. Impact and longevity of measles-associated immune suppression: a matched cohort study using data from the THIN general practice database in the UK. BMJ Open. 2018;8(11):e021465.
doi: 10.1136/bmjopen-2017-021465 - 10.
Distribution of causes of death among children aged < 5 years (%). World Health Organization. Available from: https://www.who.int/data/gho/data/indicators/indicator-details/GHO/distribution-of-causes-of-death-among-children-aged-5-years-(-)
- 11.
Portnoy A, Jit M, Ferrari M, Hanson M, Brenzel L, Verguet S. Estimates of case-fatality ratios of measles in low-income and middle-income countries: a systematic review and modelling analysis. Lancet Glob Health. 2019;7(4):e472-e481.
https://doi.org/10.1016/s2214-109x(18)30537-0 - 12.
Gignoux E, Polonsky J, Ciglenecki I, et al. Risk factors for measles mortality and the importance of decentralized case management during an unusually large measles epidemic in eastern Democratic Republic of Congo in 2013. In: Arez AP, ed. PLoS One. 2018;13(3):e0194276. doi: 10.1371/journal.pone.0194276
- 13.
Aaby P, Bukh J, Lisse IM, Smits AJ. Overcrowding and intensive exposure as determinants of measles mortality. Am J Epidemiol. 1984;120(1):49-63. doi: 10.1093/oxfordjournals.aje.a113874
- 14.
Sbarra AN, Jit M, Mosser JF, et al. Population-level risk factors related to measles case fatality: a conceptual framework based on expert consultation and literature review. Vaccines. 2023;11(8):1389. doi: 10.3390/vaccines11081389
- 15.
Sbarra AN, Jit M, Mosser JF, et al. Population-level risk factors related to measles case fatality: a conceptual framework based on expert consultation and literature review. Vaccines. 2023;11(8):1389. Available from: https://doi.org/10.3390/vaccines11081389
- 16.
Sbarra AN, Mosser JF, Jit M, Ferrari M, Ramshaw RE, O’Connor P, et al. Estimating national-level measles case–fatality ratios in low-income and middle-income countries: an updated systematic review and modelling study. The Lancet Global Health [Internet]. 2023 Apr 1;11(4):e516–24. Available from: https://www.sciencedirect.com/science/article/pii/S2214109X23000438