La rougeole est une infection virale aiguë extrêmement contagieuse, qui touche principalement les enfants et pour laquelle il n’existe aucun traitement spécifique. Elle se manifeste par une éruption cutanée fébrile associée à des signes d’infection respiratoire.
1.1.1 Importance du problème
L’introduction d’un vaccin efficace et peu coûteux dans les années 60 a permis de diminuer l’importance de la maladie au niveau mondial. Néanmoins, la rougeole reste un problème majeur de santé publique dans les pays où les faibles couvertures vaccinales atteintes (principalement en Afrique et en Asie aujourd’hui) entraînent la persistance de la maladie et sont à l’origine d’épidémies de grande ampleur (Figure 1.1).
En 2010, 181 pays ont déclaré conjointement plus de 254 000 cas de rougeole
a
Citation
a.
Pour obtenir les données les plus récentes, consulter le site :
http://www.who.int/immunization_monitoring/diseases/measlesregionalsummary.pdf
. Selon l’OMS, malgré l’amélioration globale de la surveillance épidémiologique, ces chiffres seraient encore largement sous-estimés.
Figure 1.1 : Incidence des cas de rougeole déclarés pour 100 000 habitants en 2010
Source : OMS/IVB
1.1.2 Agent infectieux
La rougeole est due à un paramyxovirus (virus morbilleux), dont le réservoir est exclusivement humain (personnes infectées, y compris asymptomatiques).
Les termes « clade » et « génotype » sont utilisés pour décrire les caractéristiques génétiques des virus sauvages.
Huit clades (désignés par les lettres A à H) et 22 génotypes sont actuellement connus. Leur répartition est variable selon les régions
[1]
Citation
1.
Weekly epidemiological record. No. 51/52, 2006, 81, 469–480.
http://www.who.int/wer/2006/wer815152.pdf
[2]
Citation
2.
Weekly epidemiological record. No. 9, 2012, 87, 73–80
http://www.who.int/wer/2012/wer8709.pdf
:
- En Afrique, les clades B et D sont dominants avec plusieurs génotypes identifiés.
- En Asie du sud-est, le clade D est dominant avec de nombreux génotypes.
- Dans la région Pacifique, il y a une grande variabilité des clades et de génotypes.
La caractérisation moléculaire des virus rougeoleux permet d’en identifier l’origine, de surveiller leur circulation et toute modification du génotype. Elle est indispensable pour documenter l’impact des programmes de lutte contre la rougeole au plan mondial.
1.1.3 Transmission
La transmission se fait principalement par contact direct avec des sécrétions du nez ou de la gorge, par voie aérienne et rarement de manière indirecte.
Les gouttelettes de Pflügge émises par le sujet infecté contaminent le sujet indemne en pénétrant les muqueuses nasales, buccales, laryngées ou conjonctivales. Le virus peut rester en suspension dans l’air pendant plus de 2 heures mais survit peu de temps sur les objets et les surfaces.
La période de contagiosité débute 3 à 4 jours avant l’apparition de l’éruption cutanée et persiste jusqu’à 5 jours après le début de l’éruption. Elle peut être plus longue chez les sujets malnutris ou immunodéprimés.
1.1.4 Immunité naturelle
L’immunité peut être acquise naturellement (en contractant la maladie) ou par la vaccination.
Chez le sujet contaminé, les anticorps IgM peuvent être détectés dès l’apparition de l’éruption et persistent pendant environ un mois. Les IgG apparaissent quelques jours plus tard et restent détectables à vie. L’infection naturelle entraîne donc une protection à vie.
C’est l’activation de la réponse immunitaire qui permet l’élimination du virus. Cette activation provoque, paradoxalement, l'apparition d'une immunodépression transitoire persistant 1 à 6 semaines après l’éruption [3] Citation 3. Speziani C, Laine D, Servet-Delprat C, Valentin H, Rabourdin-Combe C. Virus de la rougeole et immunosuppression. Med Mal Infect 2004 ; 34 (s1) 2-6. , qui serait à l'origine de la majeure partie des complications infectieuses et des décès associés à la rougeole.
1.1.5 Vulnérabilité
Les anticorps maternels, transmis via le placenta et le lait maternel, protègent les nourrissons durant les premiers mois de vie puis disparaissent progressivement vers l’âge de 5 à 12 mois.
Après disparition des anticorps, tous les enfants deviennent « susceptibles », c.-à-d. à risque de développer la maladie en cas de contamination.
On estime que, dans une population non vaccinée, presque tous les enfants auront développé la rougeole avant l’adolescence. C’est la probabilité de contact avec un sujet atteint de rougeole qui déterminera l’âge de survenue de la maladie mais classiquement, les enfants de moins de 5 ans, et plus spécifiquement de moins de 3 ans, sont les plus touchés.
Lorsqu’une vaccination a lieu, une petite proportion des personnes vaccinées ne développe pas d’immunité (efficacité vaccinale 80-95%). Ces personnes ne seront pas protégées par le vaccin et seront toujours à risque de développer la maladie en cas de contamination.
1.1.6 Létalité
Dans les pays industrialisés, la létalité est faible et la maladie est souvent, à tort, considérée comme bénigne. L’OMS estime que 4% des décès d’enfants de moins de 5 ans dans le monde sont attribuables à la rougeole
[4]
Citation
4.
World Health Organization. The global burden of disease: 2004 update. 2004. WHO Press, Geneva 27, Switzerland, World Health organization WHO.
http://www.who.int/healthinfo/global_burden_disease/GBD_report_2004update_full.pdf
et que 90% des personnes qui décèdent des suites d’une rougeole ont moins de 5 ans.
Au cours d’épidémies dans les pays en développement, la létalité globale (précoce et tardive) peut varier de 3 à 15%. En situation d’urgence (camp de réfugiés, populations déplacées, etc.), en zone à forte prévalence de malnutrition aiguë ou en zone urbaine précaire, elle peut être supérieure à 20% [5] Citation 5. Wolfson LJ, Grais RF, Luquero FJ, Birmingham ME, Strebel PM. Estimates of measles case fatality ratios: a comprehensive review of community-based studies. Int J Epidemiology. 2009;38:192–205. .
La létalité précoce (< 30 jours) varie de 1 à 5% [6] Citation 6. Grais RF, Dubray C, Gerstl S, Guthmann JP, Djibo A, Nargaye KD, Coker J, Alberti KP, Cochet A, Ihekweazu C, Nathan N, Payne L, Porten K, Sauvageot D, Schimmer B, Fermon F, Burny ME, Hersh BS, Guerin PJ. Unacceptably high mortality related to measles epidemics in Niger, Nigeria, and Chad. PLoS Med. 2007 Jan;4(1):e16. et la létalité hospitalière de 6 à 34% [7] Citation 7. Malfait P, Jataou IM, Jollet MC, et al. Measles epidemic in the urban community of Niamey: transmission patterns, vaccine efficacy and immunization strategies, Niger, 1990 to 1991. Pediatr Infect Dis J 1994; 13:38-45. selon les contextes.
Les facteurs de risque de mortalité sont :
- âge inférieur à 3 ans ;
- malnutrition aiguë ;
- carence en vitamine A ;
- immunodépression.
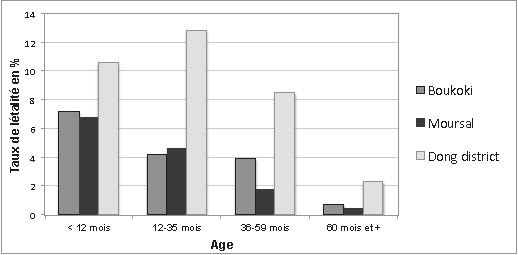
Trois enquêtes récentes de mortalité rétrospective6 de la rougeole ont confirmé que la létalité des moins de 5 ans était nettement supérieure à celle des enfants plus âgés (Figure 1.2). En milieu urbain, la létalité était plus élevée chez les enfants de moins de 1 an et diminuait avec l'âge. En zone rurale, la létalité était plus élevée qu’en zone urbaine dans toutes les classes d’âge. Partout, la létalité révélée par les enquêtes était supérieure à celle précédemment déclarée car la majorité des décès survenus à la maison n’avaient pas été comptabilisés.
Figure 1.2 : Taux de létalité de la rougeole par classe d’âge sur 3 sites : Boukoki (zone urbaine, Niger), Moursal (zone urbaine, Tchad), Dong (zone rurale, Nigéria)
Source : Epicentre/MSF
- (a)Pour obtenir les données les plus récentes, consulter le site :
http://www.who.int/immunization_monitoring/diseases/measlesregionalsummary.pdf
- 1.Weekly epidemiological record. No. 51/52, 2006, 81, 469–480.
http://www.who.int/wer/2006/wer815152.pdf - 2.Weekly epidemiological record. No. 9, 2012, 87, 73–80
http://www.who.int/wer/2012/wer8709.pdf - 3.Speziani C, Laine D, Servet-Delprat C, Valentin H, Rabourdin-Combe C. Virus de la rougeole et immunosuppression. Med Mal Infect 2004 ; 34 (s1) 2-6.
- 4.World Health Organization. The global burden of disease: 2004 update. 2004. WHO Press, Geneva 27, Switzerland, World Health organization WHO.
http://www.who.int/healthinfo/global_burden_disease/GBD_report_2004update_full.pdf - 5.Wolfson LJ, Grais RF, Luquero FJ, Birmingham ME, Strebel PM. Estimates of measles case fatality ratios: a comprehensive review of community-based studies. Int J Epidemiology. 2009;38:192–205.
- 6.Grais RF, Dubray C, Gerstl S, Guthmann JP, Djibo A, Nargaye KD, Coker J, Alberti KP, Cochet A, Ihekweazu C, Nathan N, Payne L, Porten K, Sauvageot D, Schimmer B, Fermon F, Burny ME, Hersh BS, Guerin PJ. Unacceptably high mortality related to measles epidemics in Niger, Nigeria, and Chad. PLoS Med. 2007 Jan;4(1):e16.
- 7.Malfait P, Jataou IM, Jollet MC, et al. Measles epidemic in the urban community of Niamey: transmission patterns, vaccine efficacy and immunization strategies, Niger, 1990 to 1991. Pediatr Infect Dis J 1994; 13:38-45.