6.6.1 Qualité des vaccins
A chaque niveau (capitale, périphérie) :
- Pour les vaccins : contrôler le nom, l’origine de l’envoi, la qualité des produits, l’étiquetage, la date de péremption, la quantité livrée et le numéro de lot. Si doute, contacter le pharmacien.
- La composition et le volume du solvant peuvent être variables. Vérifier que le solvant fourni correspond au vaccin (type, étiquetage, quantité, péremption) et utiliser uniquement celui livré par le fabricant. En cas de perte accidentelle du solvant, contacter le pharmacien ou le fabricant pour connaître la conduite à tenir.
- Tout flacon de vaccin reconstitué et non utilisé dans les 6 heures doit obligatoirement être éliminé.
- Les flacons reconstitués doivent être maintenus en chaîne de froid entre 2 et 8 °C
(dans l’incision de la mousse) et à l’abri de la lumière. - Lors de la première réception de vaccins ou lors de la réception d’un vaccin d’un autre fabricant, lire la notice pour connaître les spécificités du produit.
- Examiner les produits (le solvant doit être limpide et sans dépôt).
- Vérifier qu’il n’y a pas eu de rupture de la chaîne de froid pendant le transport et le stockage des vaccins : pastille de contrôle des vaccins (PCV) (Annexe 41) et autres outils de surveillance de température utilisés.
Attention : les vaccins rougeole ne sont pas sensibles à la congélation, mais une exposition à des températures supérieures à 8 °C peut entraîner une diminution de l’efficacité du vaccin rapidement après sa reconstitution. En cas de rupture de chaîne de froid, placer les vaccins en quarantaine, dans un réfrigérateur entre +2 °C et +8 °C, avec la mention « NE PAS UTILISER », en attente de la décision du pharmacien responsable ; compléter le rapport de rupture de chaîne de froid (Annexe 42).
Ce rapport :
- Décrit l’incident : lieu, date, circonstances, origine du problème, actions mises en œuvre, nom du déclarant
- Précise :
- La liste des produits avec nom du fabricant, numéro de lot et quantités
- Les indications données par les outils de contrôles de température (Log Tag®, thermomètre, PCV, etc.)
Les vaccins en quarantaine ne peuvent être utilisés que si le responsable en donne l’autorisation après analyse du rapport.
6.6.2 Sécurité des injections
Il faut, à toutes les étapes (reconstitution du vaccin, préparation et conservation des seringues), respecter les règles d’asepsie (Annexe 34).
S’informer sur les problèmes de sécurité des injections rencontrés lors des campagnes précédentes.
Afin de garantir la sécurité des injections :
- Utiliser exclusivement des seringues auto bloquantes avec aiguille sertie pour administrer le vaccin. Elles sont à usage unique et il est impossible de les réutiliser.
- Collecter, transporter et éliminer les déchets de manière adéquate.
- Respecter la politique du lot (Bundle Policy) ci-dessous :
| Les commandes et financements comprennent systématiquement les vaccins + les seringues autobloquantes + les seringues pour reconstitution + les conteneurs de collecte et d’élimination des piquants/tranchants |
- Informer tout le personnel des risques liés aux erreurs techniques :
- Infection du personnel consécutive à une piqûre accidentelle
- Infection locale due à une injection non stérile (erreur de manipulation lors de la préparation ou de l’injection)
- Transmission virale (hépatites B, C et VIH) due à la réutilisation du matériel d’injection
- Inefficacité du vaccin due à une erreur de reconstitution ou un problème de conservation.
- Contrôler les bonnes pratiques à l’aide de la grille de supervision (Annexe 35)
6.6.3 Surveillance des manifestations post-vaccinales indésirables
[1]Citation 1.World Health Organization. Manuel Mondial Pour La Surveillance Des Manifestations Post-Vaccinales Indésirables 2015. WHO; May 2016.
La surveillance des manifestations post-vaccinales indésirables (MAPI) concerne toute personne vaccinée contre la rougeole au cours de la campagne et qui présente un ou plusieurs symptômes apparus dans les 30 jours après la vaccination, qui pourrait être en lien avec celle-ci.
Les MAPI sont détectées par une surveillance passive qui commence le premier jour de la vaccination. Le personnel de santé est formé, les définitions, outils et circuit de déclaration sont mis en place.
On distingue les MAPI mineures (fièvre, réaction au point d’injection), qui ne mettent pas en danger la personne et n’entraînent pas d’hospitalisation et les MAPI graves (p.ex. réaction anaphylactique, encéphalite), qui entraînent une hospitalisation, une incapacité ou un décès.
Le personnel de santé est formé à la détection rapide et à la prise en charge appropriée d’une réaction anaphylactique sur le site de vaccination. Chaque équipe dispose d’une ampoule d’épinéphrine (adrénaline), d’une seringue de 1 mL et d’une aiguille intramusculaire pour administrer l’épinéphrine (Annexe 43) avant le transfert à l’hôpital.
Les MAPI doivent être notifiées (Annexe 44 et Annexe 45). La notification des MAPI graves doit être immédiate, pour investigation et confirmation du lien avec la vaccination.
S’informer auprès du programme national de vaccination de la classification des MAPI en vigueur dans le pays. L’OMS propose la classification suivante :
Réaction liée à un produit vaccinal : MAPI provoquée ou accéléré par un vaccin, due à une ou plusieurs propriétés inhérentes au produit vaccinal (celui-ci ayant été administré correctement).
Réaction liée à un défaut de qualité du vaccin : MAPI provoquée ou accélérée par un vaccin due à un ou plusieurs défauts de qualité du vaccin, y compris de son dispositif d’administration tel que fourni par le fabricant.
Réaction liée à une erreur de vaccination : MAPI qui résulte d’une manipulation, prescription ou administration inadéquate du vaccin et est donc évitable par nature.
Réaction liée à l’anxiété due à la vaccination : MAPI qui est provoquée par l’anxiété que suscite la vaccination.
Evènement concomitant : MAPI dont la cause est autre que le produit vaccinal, une erreur de vaccination mais pour laquelle il existe un lien temporel avec la vaccination.
6.6.4 Prévention et contrôle des infections
Les risques d’AES sont multiples :
- Pour les vaccinateurs, le risque est élevé en raison du grand nombre d’injections effectuées à un rythme soutenu. Pour limiter les risques :
- Se faire aider par l’accompagnant :
- Préparer un espace adapté : chaise pour l’accompagnant
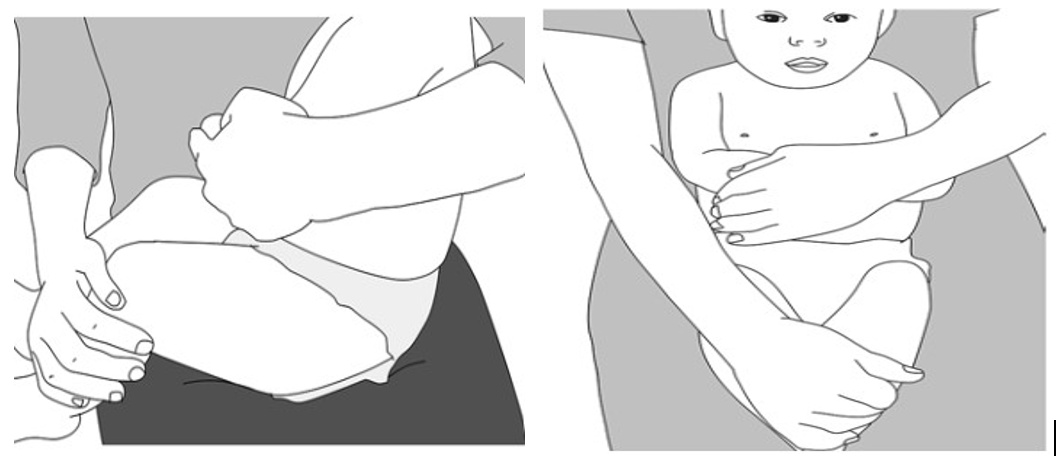
- Bien expliquer l’importance de maintenir l’enfant et comment le faire (voir Figure 6.2) [2]Citation 2.World Health Organization. Vaccination Pratique, Guide à l’Usage Des Personnels de Santé, Mise à Jour 2015. WHO; 2016.
- Le port de gants jetables ne se justifie pas, le risque d’exposition aux fluides corporels n’étant pas considéré comme significatif selon l’OMS
[3]Citation 3.World Health Organization. WHO Guidelines on Hand Hygiene in Health Care. WHO; 15 Jan. 2009.
https://www.who.int/publications/i/item/9789241597906 . - Le lavage régulier des mains est indispensable (mettre en place les moyens au niveau du site de vaccination).
- Se faire aider par l’accompagnant :
- Pour les équipes logistiques, les accidents sont liés à une mauvaise utilisation des conteneurs (remplissage au-delà de la ligne, fermeture partielle), à des erreurs de tri des déchets (aiguilles jetées dans des sacs poubelle, p.ex.) ou au transport non protégé des déchets (non isolés des personnes).
Le port de matériel de protection est obligatoire (ce matériel est inclus dans le kit vaccination) :- Pour la collecte : gants épais (au minimum gants de chantier), bleu de travail avec manches et jambes longues, bottes.
- Pour l’élimination : gants épais, tabier en cuir, bleu de travail avec manches et jambes longues, bottes, et après évaluation du risque et en fonction du mode d’élimination : lunettes de protection, masque.
Dès le début de la campagne, l’ensemble du personnel doit connaître la conduite à tenir immédiate en cas d’AES.
Un médecin référent est désigné pour :
- Evaluer le risque chez les personnes exposées, décider de la mise sous traitement et assurer le suivi (Annexe 46)
- Remplir et/ou centraliser les formulaires de déclaration d’AES (Annexe 47)
- Assurer la disponibilité constante des kits AES
Sur chaque site de vaccination et zone de stockage/élimination des déchets, un point de lavage des mains et un flacon de polyvidone iodée 10% doivent être disponibles pour assurer les soins locaux (Annexe 46).
Figure 6.2 – Bonnes positions de maintien pour l’enfant lors d’une vaccination
[2]Citation 2.World Health Organization. Vaccination Pratique, Guide à l’Usage Des Personnels de Santé, Mise à Jour 2015. WHO; 2016.
- 1.
World Health Organization. Manuel Mondial Pour La Surveillance Des Manifestations Post-Vaccinales Indésirables 2015. WHO; May 2016.
- 2.
World Health Organization. Vaccination Pratique, Guide à l’Usage Des Personnels de Santé, Mise à Jour 2015. WHO; 2016.
- 3.
World Health Organization. WHO Guidelines on Hand Hygiene in Health Care. WHO; 15 Jan. 2009.
https://www.who.int/publications/i/item/9789241597906